sábado, 23 de setembro de 2023
quarta-feira, 5 de abril de 2023
Teste seus Conhecimentos
terça-feira, 4 de abril de 2023
Ondulatória - Características e propriedades dos movimentos das ondas
________________________________________________________________
Assistam os Vídeos
quarta-feira, 22 de fevereiro de 2023
Noção de Carga Elétrica
Diferenças entre circuito série e paralelo - 8º ano
QUÍMICA - CÁLCULO DO NÚMERO DE PARTÍCULAS ATÔMICAS
O cálculo do número de partículas atômicas é utilizado para indicar a quantidade de prótons (no núcleo), elétrons (na eletrosfera) e nêutrons (no núcleo) presentes em um átomo ou íon qualquer. Para realizá-lo, é fundamental conhecer algumas características dos átomos:
1- Número atômico (Z)
É um código matemático, representado pela letra Z maiúscula, posicionado no lado esquerdo inferior da sigla de um átomo:
 ZX
Ele indica a quantidade de prótons (p) no núcleo e a quantidade de elétrons (e) na eletrosfera de um átomo. Assim, em termos gerais:
Z = p = e
2- Número de massa (A)
É um código matemático que corresponde à soma do número de prótons (p) e de nêutrons (n), ambos presentes no núcleo de um átomo qualquer. A equação que representa o número de massa é dada por:
A = p + n
Como o número de prótons é igual ao número atômico, podemos escrever a equação para calcular o número de massa da seguinte forma:
A = Z + n
Se conhecemos o número de massa e o número atômico de um átomo, podemos determinar o número de nêutrons da seguinte maneira:
n = A – Z
3- Íons
São átomos que perdem ou ganham elétrons. Apresentam um sinal positivo ou negativo posicionado na parte superior direita da sua representação, como no modelo a seguir:
X+ ou X-
ZX
Ele indica a quantidade de prótons (p) no núcleo e a quantidade de elétrons (e) na eletrosfera de um átomo. Assim, em termos gerais:
Z = p = e
2- Número de massa (A)
É um código matemático que corresponde à soma do número de prótons (p) e de nêutrons (n), ambos presentes no núcleo de um átomo qualquer. A equação que representa o número de massa é dada por:
A = p + n
Como o número de prótons é igual ao número atômico, podemos escrever a equação para calcular o número de massa da seguinte forma:
A = Z + n
Se conhecemos o número de massa e o número atômico de um átomo, podemos determinar o número de nêutrons da seguinte maneira:
n = A – Z
3- Íons
São átomos que perdem ou ganham elétrons. Apresentam um sinal positivo ou negativo posicionado na parte superior direita da sua representação, como no modelo a seguir:
X+ ou X-
-
Íon positivo: é denominado de cátion e o sinal positivo indica que ele perdeu elétrons.
-
Íon negativo: é denominado de ânion e o sinal negativo indica que ele ganhou elétrons.
a) Isótopos
Átomos que apresentam o mesmo número atômico e diferentes números de massa. Exemplo:
7X14 e 7Y16
Os átomos X e Y possuem mesmo número atômico (à esquerda da sigla), isto é, igual a 7. Já o átomo X possui número de massa (à direita da sigla) igual a 14, e o átomo Y apresenta número de massa igual a 16.
b) Isóbaros
Átomos que apresentam o mesmo número de massa e diferentes números atômicos. Exemplo:
15X31 e 13Y31
Os átomos X e Y possuem número de massa (à direita da sigla) igual a 31. Já o átomo X possui número atômico igual a 15, e o átomo Y apresenta número atômico igual a 13.
c) Isótonos
Átomos que apresentam diferentes números de massa e números atômicos, mas o mesmo número de nêutrons.
d) Isoeletrônicos
Átomos que apresentam o mesmo número de elétrons. Exemplo:
12X+2 e 7Y-3
O átomo X possui número atômico igual a 12 e é um cátion (com carga positiva +2), por isso, perde dois elétrons, tendo, então, 10 elétrons na sua eletrosfera. Já o átomo Y possui número atômico igual a 7 e é um ânion (com carga negativa -3), por isso, ganha três elétrons, tendo, então, 10 elétrons na sua eletrosfera.
Exemplos do cálculo do número de partículas atômicas
Exemplo 1: Determine o número de prótons, nêutrons e elétrons do átomo 14X29.
Foram dados os seguintes valores referentes ao átomo X:
-
Número de massa (à direita superior) = 29
-
Número atômico (à esquerda inferior) = 14
-
Para determinar o número de prótons:
O número de prótons é sempre igual ao número atômico, por isso, o átomo X possui 14 prótons.
-
Para determinar o número de elétrons:
Como o átomo X não é um íon, logo, o número de elétrons é igual ao número de prótons, ou seja, 14.
-
Para determinar o número de nêutrons:
O número de nêutrons é determinado utilizando-se o número de massa e de prótons na fórmula a seguir:
A = p + n
29 = 14 + n
29 – 14 =n
n = 15
Exemplo 2: Determine o número de prótons, nêutrons e elétrons do íon X+3, sabendo que seu número de massa e número atômico são, respectivamente, 51 e 23.
Foram dados os seguintes valores referentes ao íon X:
-
Número de massa = 51
-
Número atômico (à esquerda inferior) = 23
-
Para determinar o número de prótons:
O número de prótons é sempre igual ao número atômico, por isso, o átomo X possui 23 prótons.
-
Para determinar o número de elétrons:
O íon X é positivo (+3), logo, é um cátion que perdeu três elétrons. Assim, seu número de elétrons é 20.
OBS.: A redução ou aumento do número de elétrons sempre ocorrem em relação ao número atômico.
-
Para determinar o número de nêutrons:
O número de nêutrons é determinado por meio do número de massa e de prótons na fórmula a seguir:
A = p + n
51 = 23 + n
51 – 23 =n
n = 28
Exemplo 3: Um átomo W possui número atômico e de massa iguais a, respectivamente, 29 e 57, sendo isóbaro de um átomo Y, que possui número atômico igual a 30, o qual é isótono de um átomo B, cujo número de massa é 65. Com essas informações, determine o número de prótons, nêutrons e elétrons do átomo B.
Dados fornecidos pelo exercício:
-
Átomo W
número atômico (à esquerda inferior) = 29
número de massa (à direita superior) = 57
Isóbaro de Y, ou seja, a massa de Y também é 57.
-
Átomo Y
número atômico = 30
número de massa = 57
Com esses dois valores, devemos determinar o seu número de nêutrons porque ele é isótono do elemento B:
A = Z + n
57 = 30 + n
57 – 30 = n
n = 27
-
Átomo B:
número de massa = 65
número de nêutrons = 27
Com esses dados, devemos determinar seu número atômico, pois, com isso, estaremos determinando seu número de prótons e seu número de elétrons (já que ele não é um íon):
A = Z + n
65 = Z +27
65 – 27 = Z
Z = 38
Logo, o átomo B apresenta 38 prótons, 38 elétrons e 27 nêutrons.
O cálculo do número de partículas atômicas é utilizado para indicar a quantidade de prótons (no núcleo), elétrons (na eletrosfera) e nêutrons (no núcleo) presentes em um átomo ou íon qualquer. Para realizá-lo, é fundamental conhecer algumas características dos átomos:
domingo, 12 de fevereiro de 2023
sábado, 11 de fevereiro de 2023
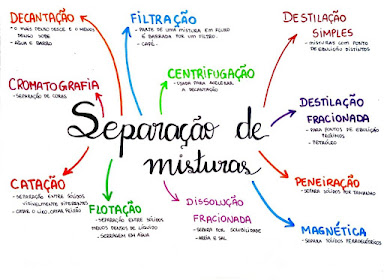
Separação de misturas - 6º Ano
Os métodos de separação de misturas são utilizados com o intuito de separar todos ou a maioria das substâncias que formam uma mistura.
Separação de misturas significa isolar um ou mais
componentes (substâncias) que formam a mistura, seja ela homogênea (que
apresenta apenas um aspecto visual, fase) ou heterogênea (que apresenta pelo
menos dois aspectos visuais, fases).
Para realizar a separação dos componentes de uma
mistura é necessária a utilização de um ou mais métodos. Abaixo, temos uma
relação de diversos métodos de separação de misturas, porém alguns mais
utilizados em misturas homogêneas, já outros em misturas heterogêneas:
OBS.: De uma forma geral a separação dos componentes de
uma mistura quase sempre necessita da utilização de mais de um método.
Misturas heterogêneas
Catação: método de separação utilizado para separar
os componentes de uma mistura formada por sólidos de tamanhos diferentes, ou de
um sólido não dissolvido no líquido, utilizando recursos como as mãos, uma
pinça, um pegador etc., para fazer a retirada de um sólido. Exemplo: separar
pedras dos grãos de feijão.
Levigação: método que utiliza a força da água para
arrastar o componente menos denso de uma mistura formada por sólidos de
diferentes densidades. Exemplo: separar o cascalho do ouro.
Ventilação: método que utiliza a força do vento para
arrastar o componente menos denso de uma mistura formada por sólidos de
diferentes densidades. Exemplo: separar a casca do grão de amendoim.
Flotação: método no qual um líquido é adicionado a
uma mistura formada por dois sólidos, os quais não se dissolvem e um deles é
mais denso, enquanto o outro é mais denso que o líquido. Em seguida uma
decantação é realizada. Exemplo: adicionar água em uma mistura formada por areia
e isopor.
Sifonação: Método no qual utilizamos mangueira,
pipeta, canudo, seringa e etc, para retirar o líquido mais denso ou o menos
denso de uma mistura formada por apenas líquidos. Exemplo: Separar os
componentes da mistura formada por água e óleo.
Filtração: método no qual um filtro de papel retem o
componente sólido de uma mistura formada por um sólido e um gás, ou um sólido
não dissolvido em um líquido. Exemplo: separar a areia da água.
Filtração a vácuo: é um método que acelera a velocidade
da realização de uma filtração. Isto ocorre porque o líquido filtrado não
apresenta a resistência do ar ao cair dentro do recipiente. Exemplo: separar
areia da água ou uma mistura pastosa.
Decantação: Método no qual o componente menos denso
da mistura (formada por um sólido não dissolvido em um líquido, ou entre dois
líquidos que não se dissolvem) é posicionado em cima do componente mais denso,
devido a ação da gravidade. Exemplo: separar barro da água.
Separação com funil de bromo: é um equipamento específico
com o qual é possível separar o líquido mais denso do líquido menos denso de
uma mistura formada por líquidos imiscíveis, após a realização de uma
decantação dos mesmos. Exemplo: separar água e óleo.
Centrifugação: é um método que acelera o fenômeno da
decantação, quando a mistura é submetida a movimentos de translação em um
equipamento denominado centrífuga
Separação magnética: método no qual um ímã é
utilizado para retirar o componente metálico presente em uma mistura formada
por sólidos. Exemplo: separar a limalha de ferro da areia.
Dissolução fracionada: método no qual um líquido é
adicionado a uma mistura formada por dois sólidos com o objetivo de dissolver
apenas um deles. Exemplo: adicionar água em uma mistura formada por sal e
areia.
Coagulação: método no qual uma substância é
adicionada a uma mistura com o intuito de se unir à componentes sólidos que
estejam em suspensão em um líquido. Exemplo: adicionar sulfato de alumínio na
água em uma estação de tratamento de água.
Floculação: é um método que complementa a coagulação,
já que nele a mistura é agitada para favorecer a ação do coagulante.
Tamisação: método no qual utiliza-se uma peneira para
separar grãos sólidos de tamanho maior presentes em uma mistura. Peneirar a
farinha de trigo.
Misturas
homogêneas
Fusão fracionada: método utilizado para separar os
componentes de uma mistura homogênea formada apenas por sólidos que apresentam
diferentes pontos de fusão. A mistura é aquecida até atingir o menor ponto de
fusão. Assim, em seguida, por filtração ou peneiração, o sólido restante é
separado do líquido. Exemplo: separação dos componentes do ouro 18 quilates.
Solidificação fracionada: método utilizado para
separar os componentes de uma mistura formada por líquidos miscíveis que
apresentem diferentes pontos de fusão através do resfriamento da mistura. A
temperatura é diminuída até o menor ponto de fusão para que apenas um dos
componentes seja transformado em sólido. Exemplo: separar a parafina dos
resíduos do petróleo.
Evaporação: método utilizado quando não temos o
objetivo de reutilizar o líquido presente na mistura. Assim, ao evaporar o
sólido é separado. Exemplo: separação da água do sal em uma salina.
Destilação simples: método utilizado para separar os
componentes de uma mistura formada por um sólido dissolvido em um líquido. Nele
o líquido é vaporizado e em seguida condensado, sendo recolhido em um outro recipiente.
Exemplo: separar a mistura água e sal.
Destilação fracionada: método utilizado para separar
os componentes de uma mistura formada por dois ou mais líquidos miscíveis (que
estão dissolvidos entre si). A mistura é aquecida fazendo com que os líquidos
sejam vaporizados, porém antes de serem condensados, os vapores são separados
em uma coluna de fracionamento. Exemplo: separar a mistura formada por água e
acetona.
Destilação por arraste de vapor: método que utiliza o
calor do vapor de água sobre uma mistura para fazer um componente dela
vaporizar. Exemplo: obtenção de essências a partir de plantas.